台灣團隊產學聯手,領先全球,首創「CRISPR-AI雙向基因調控系統」,讓幹細胞可以同時活化與抑制不同基因表現。這項技術有機會應用在常見的退化性關節炎,幫助病人組織再生。
科技部計畫支持下,清華大學化工系講座教授胡育誠與中國醫藥大學助理教授林進裕、長庚醫院骨科醫師張毓翰組成跨校、跨領域合作團隊,研究歷時6至7年開發「CRISPR-AI雙向基因調控系統」,這項成果對再生醫學研究與病人組織再生將有重大幫助。
胡育誠表示,人體具備很多幹細胞,可以分化成特殊功能的細胞,像是間葉幹細胞可分化成軟骨、硬骨或脂肪等不同細胞,但本身容易往脂肪分化,造成頭蓋骨增生效果不彰。過程中,如果基因調控功能不佳,無法控制細胞分化,會影響組織修復效果。
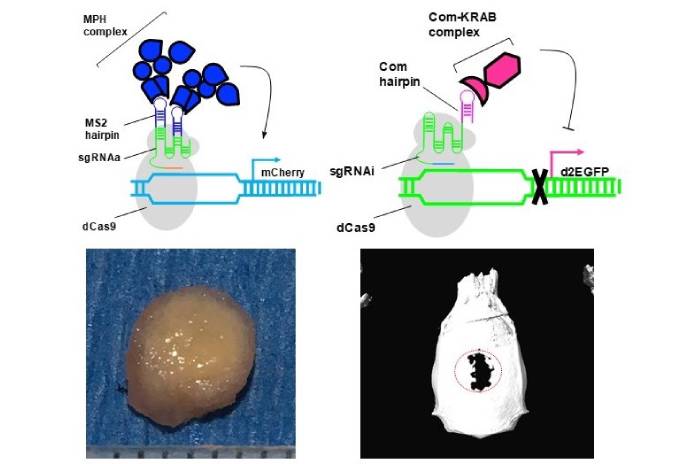
胡育誠解釋,CRISPR-AI雙向基因調控系統就好比電燈開關中控系統,以前只能單向控制開啟或關閉某種基因表現,但是這項技術可以決定「同時要開哪些燈、關哪些燈」。
如果CRISPR-AI送入幹細胞後,胡育誠表示,與原本幹細胞相比,可以同時活化「促進幹細胞往軟骨細胞分化的基因Sox9」表現1.7倍,並抑制「促進脂肪分化的基因PPAR-γ」,表現達70%。大幅提高幹細胞基因分化成軟骨細胞的效率。
胡育誠提到,人體組織向膝關節軟骨與頭蓋骨自我修復能力不佳,像是退化性關節。但未來用在幹細胞研究,有機會修復關節軟骨,治療退化性關節炎,或修復其他組織。
胡育誠表示,目前癌症治療的新趨勢為應用免疫細胞進行免疫療法,CRISPR-AI系統也具備改造免疫細胞的潛力,增加免疫細胞毒殺癌細胞能力。目前也有其他科技部計畫正與俄羅斯團隊進行後續研究應用。