編譯:李順瑭|圖:編輯部
編譯:李順瑭|圖:編輯部
美
國政府指派的衛生專家小組11月30日周二進行表決,支持讓高風險成人病患在首度出現症狀的5天內,服用默沙東Merck藥廠研製的COVID-19武漢肺炎口服藥。
國際媒體報導,衛生專家小組有13人投票支持、10人反對,由於票數非常接近,反映出他們對近期下修這種治療療效的擔憂,以及這種治療方式可能造成傷害的疑慮。
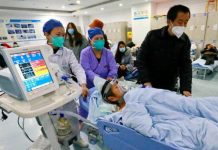
南非COVID-19新變種病毒「Omicron」為全球帶來新隱憂之際,臺灣衛福部11月27日周六證實,美國默沙東Merck藥廠COVID-19口服藥已於11月中送審,力拚12月中完成,在臺灣緊急使用授權EUA審查。對此,臺灣林口長庚醫院病毒室主任施信如認為,現行多種COVID-19變異株尚無抗藥性,因此口服藥面對Delta或Omicron應都是有效的。
美國藥廠默沙東率先研發出全球首款COVID-19口服藥「莫納皮拉韋Molnupiravir」,然而,默沙東今證實,臨床試驗最終分析顯示,莫納皮拉韋對降低重症患者防護效果僅30%,遠低於期中數據的50%。對於最終數據是否影響臺灣購買計畫,臺灣衛福部長陳時中回應,因已簽約,計畫不會變動。